
FraxPath
FraxPath untersucht die Beziehungen zwischen der Esche als Wirtsbaumart und dem Krankheitserreger Hymenoscyphus fraxineus. Dabei werden die verschiedenen Symptome des Eschentriebsterbens (z. B. Stammfußnekrosen, Triebinfektionen, Blattnekrosen) erforscht und innovative Ansätze zum Management des Pathogens angestrebt.
Teilprojekt 1: Einfluss von Standortsfaktoren auf Stammfußnekrosen - Ätiologie, Diversität und Populationsstruktur von assoziierten Pilzen
Im Erkrankungsprozess des Eschentriebsterbens spielen Stammfußnekrosen eine entscheidende Rolle – sie tragen maßgeblich zur Mortalität der Eschen bei. Stammfußnekrosen können primär durch den Erreger des Eschentriebsterbens Hymenoscyphus fraxineus verursacht werden. Da sich dort aber auch vermehrt sekundäre Pilze ansiedeln, führen diese Nekrosen meist innerhalb kurzer Zeit zur Holzentwertung, Bruchgefährdung oder umgehend zum Absterben des betroffenen Baumes. Um die Esche als Wirtschaftsbaumart zu erhalten, ist es erforderlich die Ätiologie (Ursachen und Infektionswege) der Stammfußnekrosen sowie Faktoren, die deren Entstehung begünstigen, zu verstehen.
Dieses Teilprojekt befasst sich mit folgenden Aufgaben und Fragestellungen:
- Untersuchung der Ätiologie von Stammfußnekrosen an der Esche
- Quantifizierung des Einflusses von Standortsfaktoren auf Stammfußnekrosen
- Untersuchung der Diversität und Populationsstruktur von Pilzen, die mit den Nekrosen assoziiert sind
- Isolation von H. fraxineus Pilzstämmen für andere Teilprojekte des Gesamtverbunds
- Koordination des Verbundvorhabens FraxPath

Um den Zusammenhang zwischen Standort und Ausprägung von Stammfußnekrosen zu untersuchen, werden zum einen die Standortsdaten des bundesweiten Rasters der Bodenzustands- und Waldzustandserhebung akquiriert und ausgewertet. Auf allen Rasterpunkten mit ausreichend Eschenvorkommen werden Stammfußnekrosen, Kronenzustände und weitere ETS-Schadsymptome aufgenommen. Dazu wird der verbundweite Boniturschlüssel verwendet.
Mit den erhobenen Daten werden begünstigende Faktoren (z. B. Nährstoffversorgung, Bodenwasserhaushalt, Bodenphysik, Humusform) auf die Ausprägung der Nekrosen sowie die Gesamtschädigung der Eschen analysiert.
Einen weiteren Schwerpunkt stellen die Arbeiten auf den Intensivbeprobungsflächen des Teilprojekts dar. Dort werden die Stammfußnekrosen detailliert kartiert (Größe und Tiefe), kleinräumig Standorts- und Bodendaten zum Wuchsort jeder Esche erhoben und von ausgewählten Bäumen Stammfußproben genommen. Diese werden in einem mykologischen Labor hinsichtlich der auslösenden und assoziierten Pilze untersucht, d. h. es werden aus den Randbereichen der Nekrosen (Übergang vom abgestorbenen zum lebenden Holz) Pilze isoliert. Diese Pilze (H. fraxineus und andere assoziierte Pilze) werden morphologisch und DNA-gestützt identifiziert und hinsichtlich ihrer ökologischen Funktion charakterisiert.
Sowohl die Stämme von H. fraxineus als auch isolierte Endophyten, sekundäre Schaderreger, potentielle Antagonisten und Probenmaterial werden an andere Teilvorhaben im Gesamtverbund weitergegeben. Das Teilprojekt 3 untersucht die Stammfußproben im Detail bezüglich der Infektionswege und den Besiedlungsfortschritt des Holzes in der Rückschau.
Da Stammfußnekrosen im Schadverlauf des Eschentriebsterbens sehr oft auftreten, die Standsicherheit des Baumes gefährden und zudem auch meistens die finale Absterbeursache darstellen, ist dieser Aspekt im Gesamtschadbild von zentraler Bedeutung.
Bisher ist nicht endgültig geklärt, wie Infektionen am Stammfuß der Esche verlaufen, welche Pilze beteiligt sind und welche Faktoren die Entstehung begünstigen. Es ist zu erwarten, dass das Mykobiom (Gesamtheit der vorkommenden Pilze) sowie auch der Schädigungsgrad der Eschenstammfüße von den Standortsfaktoren Feuchtigkeit, pH, Nährstoffe abhängt. Wissen über diese Zusammenhänge ist vonnöten, um weitere Bekämpfungsstrategien zu erforschen und gezielt Maßnahmen zum Schutz der Esche zu ergreifen. Außerdem können für die weitere forstliche Praxis Standortsempfehlungen ausgesprochen werden, an denen die Entwicklung von Stammfußnekrosen weniger stark zu erwarten ist und die Baumart Esche somit eine reelle Überlebenschance hätte.
Die Isolation von H. fraxineus Pilzstämmen aus Stammfußnekrosen ist wichtig für andere mikrobiologisch oder genetisch fokussierte Teilvorhaben des Gesamtverbunds, in welchen zum Beispiel die Züchtung von resistenten Eschen und neuartige Bekämpfungsstrategien gegen den Erreger des Eschentriebsterbens entwickelt und getestet werden.

Abteilung Waldschutz und Abteilung Umweltkontrolle
Ansprechpersonen
Dr. Gitta Langer, gitta.langer@nw-fva.de
Sebastian Fuchs, sebastian.fuchs@nw-fva.de
Sandra Peters, sandra.peters@nw-fva.de
Förderkennzeichen: 2219WK22A4
Weitere Informationen zu diesem Teilprojekt finden Sie hier; eine erste Publikation ist in der Zeitschrift ImDialog (Hrsg. Landesbetrieb HessenForst) erschienen.
Teilprojekt 2: Erfassung von Populationsstrukturen, Virulenz- und Infektionseigenschaften durch Mikrosatellitenanalyse/Infektionsversuche
- Die Virulenz eines Krankheitserregers ist gewissermaßen seine Aggressivität: sie beschreibt, wie stark die Krankheitsausprägung ist, die das Pathogen erzeugen kann.
- Bei bisherigen Infektionsversuchen wurde festgestellt, dass sich verschiedene Isolate des Erregers des Eschentriebsterbens (Hymenoscyphus fraxineus) deutlich in ihrer Virulenz unterscheiden.
- Im hier beschriebenen Vorhaben wird untersucht, ob diese Virulenzunterschiede im Zusammenhang mit dem Ausgangssubstrat der Isolate (Blätter, Triebe oder Xylem im Stammfußbereich), mit ihrer geographischen Herkunft oder ihrer genetischen Struktur stehen.
- Dabei werden auch Standortsaspekte betrachtet.
- Ein Nebenprodukt des Vorhabens sind Einblicke in die Populationsstruktur des Krankheitserregers in Deutschland. Außerdem ist geplant, zur Klärung der Ätiologie von Stammfußnekrosen beizutragen, deren genaue Entstehungsweise nach wie vor unbekannt ist.
- Am JKI werden außerdem zusätzliche Infektionsversuche für andere Projekte des Verbundes FraxPath durchgeführt.

Die Versuchspflanzen werden zum Teil im Rahmen des Verbundprojekts FraxGen am Thünen-Institut produziert. Die zu untersuchenden pilzlichen Isolate von H. fraxineus werden von uns und verschiedenen FraxPath-Partnern aus verschiedenen Pflanzenproben (Blätter, Triebe, Holz aus dem Stammfußbereich) isoliert und in Kultur genommen. Die Pflanzenproben werden von Eschen aus den Monitoringflächen genommen, die im Rahmen des Unterverbunds FraxMon eingerichtet werden. Um die Virulenz der verschiedenen Isolate zu erfassen werden die Versuchspflanzen in kontrollierten Versuchen künstlich infiziert. Die Infektion wird mit Myzel an künstlichen Wunden herbeigeführt. Um Infektionen möglichst naturnah zu erzeugen wird aber auch die Innokulation mittels einer Suspension von Askosporen angestrebt. Um eine gewisse Kontrolle über etwaige Umwelteinflüsse zu erreichen, werden die Pflanzen im Gewächshaus gehalten. Nach der Infektion werden die Pflanzen über einen längeren Zeitpunkt genauestens beobachtet. Zu den sich entwickelnden Krankheitssymptomen und der Geschwindigkeit ihrer Entstehung werden Daten akribisch gesammelt, die dann als Maß für die Virulenz der eingesetzten Isolate dienen.
Um genetische Strukturen zwischen H. fraxineus-Isolaten zu untersuchen, wird eine Mikrosatellitenanalyse durchgeführt. Mikrosatelliten, auch simple sequence repeats (SSR) genannt, sind kurze, nichtkodierende DNA-Sequenzen, die hintereinander mehrfach wiederholt werden. Anhand von Unterschieden in der Anzahl dieser Wiederholungen zwischen Individuen einer Art lassen sich deren Verwandtschaftsstrukturen zueinander bestimmen. Für die Mikrosatellitenanalyse wird die pilzliche DNA am JKI extrahiert, während die weitere Bearbeitung der DNA-Extrakte (PCR mit SSR-Primern, Bestimmung der Amplikonlängen) anschließend durch den Projektpartner (Thünen-Institut, Unterverbund FraxGen) erfolgt. Die so gewonnenen Daten werden anschließend durch das JKI im Hinblick auf Virulenz, geographische Herkunft und Ausgangssubstrat (Blätter, Triebe, Stammfuß) ausgewertet und interpretiert. Hierfür stehen verschiedene statistische Methoden zur Verfügung, zum Beispiel F-Statistiken, AMOVA (analysis of molecular variance) oder Hauptkomponentenanalyse.
- Die großen Unterschiede in der Virulenz verschiedener Isolate des Erregers des Eschentriebsterbens können hoffentlich mit diesem Vorhaben erklärt werden.
- Dies würde tiefe Einblicke in die Lebensweise des Pathogens erlauben und Rückschlüsse auf die evolutionäre Entwicklung im neuen Verbreitungsgebiet zulassen.
- Gegebenenfalls werden Standorte oder Gebiete identifiziert, in denen die Virulenz von H. fraxineus besonders hoch oder gering ist.
- Gegebenenfalls sind Aussagen über die historische Ausbreitung des Pilzes in Deutschland möglich.
- Gegebenenfalls sind Aussagen über die zukünftige Entwicklung der Virulenz von H. fraxineus möglich. Dies ist insbesondere im Hinblick auf langfristige Züchtungsarbeiten von Interesse.
- Auf dieser Basis könnten bisherige Strategien im Umgang mit dem Eschentriebsterben optimiert und neue Strategien entwickelt werden.
- Diese Arbeiten tragen vermutlich auch zu einem generell besseren Verständnis über die Evolution und Populationsentwicklung von invasiven Forstpathogenen außerhalb ihrer natürlichen Verbreitungsgebiete bei.
- Die Infektionsversuche liefern Daten zum Grad der Virulenz bestimmter Isolate. Verbundpartner können mithilfe dieser Daten die für ihre Versuchszwecke geeigneten Isolate gezielt aussuchen. So sind zum Beispiel beim Testen der Resistenz von Einzelbäumen gegenüber dem Eschentriebsterben (vergleiche Unterverbund FraxGen) besonders die virulenteren Stämme geeignet.

Ansprechperson
Dr. Rasmus Enderle, rasmus.enderle@julius-kuehn.de
Förderkennzeichen: 2219WK22B4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.
Teilprojekt 3: Histologische und dendrochronologische Untersuchungen im Zusammenhang mit Stammfußnekrosen
Neben den allgegenwärtigen Symptomen des Eschentriebsterns im Kronenbereich treten vermehrt auch Stammfußnekrosen an Eschen in Erscheinung. Dieses Symptom wird zusammen mit dem Teilprojekt 1 näher erforscht. Dieses Teilprojekt befasst sich mit folgenden Aufgaben:
- Zustandekommen und Ablauf von Stammfußnekrosen an Eschen aufklären
- Mögliche Infektionen über Lenticellen, Wunden oder die Wurzel und Unterschiede von Resistenzmechanismen untersuchen
- Retrospektive dendrochronologische Datierungen von Infektionen und deren Fortschreiten im Stammfuß

- Dendrochronologische Datierungen vorhandener Stammfußnekrosen ermöglichen eine zeitliche Einordung der Infektionen
- Beschreibung der zeitlichen Pathogenese
- mikroskopische Analysen histologischer Präparate liefern Einblicke in die Infektionsmechanismen und den Schadensverlauf am Stammfuß
- Infektionsversuche an Wurzelanläufen
- Untersuchung der Fäuledynamik in Holz aus Stammfußbereichen in kontrollierten Laborversuchen
Zwar ließ sich der Erreger des ETS aus nekrotischen Stammfüßen von Eschen isolieren, der Infektionsweg in die Stammfüße ist jedoch ungeklärt. Genaue Erkenntnisse zu den Infektionsvorgängen an Stammfüßen von Eschen können helfen, Veränderungen hinsichtlich einer Stand- und Bruchgefährdung der Bäume zu beurteilen. Damit können derartige Schädigungen frühzeitig erkannt, verbundene Risiken (z. B. für Waldbesuchende oder arbeitende Menschen) minimiert und Eschenbestände stabilisiert werden.
Kenntnisse zur Dynamik der Holzzersetzung durch den Pilz erlauben die Beurteilung der Dringlichkeit von Sanierungsmaßnahmen.

Abteilung Waldschutz
Ansprechperson
Luisa Knauf, luisa.knauf@forst.bwl.de
Förderkennzeichen: 2219WK22C4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.
Teilprojekt 4: Ätiologie, Diversität und Populationsstruktur von Pilzen in der Rhizosphäre - bodenbürtige Infektionen von Hymenoscyphus fraxineus an Wurzel und Wurzelstock
- Isolation von H. fraxineus und anderer Pilze aus der Rhizosphäre von Eschenbeständen und Identifikation der Isolate mittels DNA-Barcoding und Morphologie
- Versuch des Nachweises von H. fraxineus auch im Boden und damit Aufklärung eines möglichen weiteren Infektionsweges
- Durchführung von in vitro-Versuchen mit isolierten Rhizosphäre-Pilzen als mögliche Antagonisten gegen H. fraxineus
- Korrelation der Biodiversität von Rhizosphäre-Pilzen mit abiotischen Parametern wie pH-Wert oder Nährstoffgehalt
- Charakterisierung und Einschätzung der forstlichen Relevanz von Rhizosphäre-Pilzen

Zuerst erfolgt die Isolation von Pilzen aus der Rhizosphäre unterschiedlich geschädigter Individuen von Fraxinus excelsior auf unterschiedlichen Standorten. Hierzu werden im Gelände Starkwurzeln freigelegt und von diesen abgehende Feinwurzeln beprobt. Die Gewinnung von Reinkulturen erfolgt über das Auslegen von Wurzelstückchen bzw. das Auftragen von Verdünnungsreihen auf verschiedene Nährmedien. Die isolierten Reinkulturen werden im Anschluss durch DNA-Barcoding möglichst Art-genau bestimmt. Zusätzlich findet eine Untersuchung von Wurzel- und Bodenproben mittels next generation sequencing statt. Dieses Verfahren ermöglicht einen kulturunabhängigen Nachweis von Pilzen mittels DNA. Des Weiteren soll durch den Einsatz von art-spezifischen Primern überprüft werden, ob H. fraxineus auch im Boden außerhalb von Eschen vorhanden ist. Mögliche H. fraxineus-Isolate sollen mittels Mikrosatelliten-Fragmentanalyse genotypisiert werden. Es erfolgen in vitro Antagonistenversuche mit ausgewählten Pilz-Reinkulturen. Hierbei wird eine mögliche Hemmwirkung der Rhizosphären-Pilze auf unterschiedlich virulente H. fraxineus-Stämme getestet. Abschließend soll eine statistische Auswertung der gewonnen Daten erfolgen. Hierzu erfolgt unter anderem eine Korrelation der Biodiversität der Rhizosphäre-Pilze mit abiotischen Parametern, welche von anderen Projektpartnern geliefert werden. Zusätzlich soll anhand von Literatur die Charakterisierung und Einschätzung der forstlichen Relevanz von isolierten Pilzarten mit bekannter ökologischer Funktion erfolgen.
Die genaue Kenntnis des Mykobioms der Rhizosphäre eröffnet Handlungsmöglichkeiten zur Sicherung von Eschenbeständen. Durch die Erforschung der pilzlichen Diversität an Eschenwurzeln und die Untersuchung der Interaktion des Eschentriebsterben-Erregers mit ausgewählten Pilzarten können die Auswirkungen des Eschentriebsterbens auf die pilzliche Biozönose ermittelt werden; diese Studien erfolgen in Laborexperimenten. Dadurch sollen Möglichkeiten und Wege zur Bekämpfung des Eschentriebsterbens aufgezeigt sowie zur Entwicklung waldbaulicher Maßnahmen beigetragen werden. Gegebenenfalls können weitere Infektionswege aufgedeckt werden.
Die Entwicklung biologischer Kontrollsysteme als Ansatzpunkte für eine Bekämpfung des Eschentriebsterbens mit Antagonisten sind wesentlicher Schwerpunkt von FraxForFuture; Beiträge hierzu leisten auch andere Teilprojekte.
Die genetische Zusammensetzung der detektierten H. fraxineus-Stämme, die durch Mikrosatellitenanalyse aufgefächert werden, ermöglicht zukünftig die Einordnung in schwächer oder stärker pathogene Stämme und ihre räumliche Verteilung in Beständen. Die Ermittlung des Einflusses von abiotischen Faktoren und des Mykobioms auf H. fraxineus und das Eschentriebsterben schafft ein vertieftes ökosystemares Verständnis. Die erstmalige Übersicht über die Pilzarten der Rhizosphäre und die Veröffentlichung von DNA-Sequenzen kann von zukünftigen Projekten als Referenz benutzt werden.

Ansprechpersonen
Prof. Dr. Ewald Langer, ewald.langer@uni-kassel.de
Ludmila Lysenko, ludmila.lysenko@uni-kassel.de
Förderkennzeichen: 2219WK22D4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.
Teilprojekt 5: Analysen von Pathogen-Wirt-Interaktionen zur Identifizierung differentiell exprimierter Genmarker von Hymenoscyphus fraxineus
- Vergleichende Analysen zur Genexpression bei H. fraxineus auf anfälligen und widerstandsfähigen Eschen zur Identifikation der Schlüsselgene (art- und gewebeabhängig)
- Analysen der Pathogen-Wirt-Interaktionen sowie der damit verbundenen Metabolite
- Ursachen in die unterschiedlichen Infektionsverläufe (lokal begrenzt und invasiv)

In diesem Teilvorhaben werden Transkriptomdaten (RNA-Seq) von H. fraxineus erhoben. Die Anzucht des Pathogens erfolgt sowohl in vitro auf mit Blattsubstrat supplimierten Nährmedien als auch in planta. Es werden Eschenarten ausgewählt, die auf eine Infektion entweder anfällig oder widerstandsfähig reagieren. Durch eine vergleichende Analyse der Transkriptomdaten soll ein Einblick in die unterschiedlichen Infektionsverläufe gewonnen und die Schlüsselgene identifiziert werden. Die Evaluierung der Expression von Genmarkern erfolgt in selektiertem anfälligen bzw. widerstandsfähigem Vermehrungsgut aus Blatt- und Stammfußnekrosen.
- Es werden Erkenntnisse zu Pathogen-Wirt-Interaktionen gewonnen, insbesondere zu den Faktoren, die eine endophytische oder nekrophytische Kolonisation ermöglichen.
- Durch die Zusammenarbeit mit den anderen Teilvorhaben sollen zudem Erkenntnisse abgeleitet und bewertet werden, die zu einer Hemmung des Wachstums oder Herabsetzung der Virulenz des Pathogens führen.

Ansprechperson
Prof. Dr. Michael Kube, michael.kube@uni-hohenheim.de
Förderkennzeichen: 2219WK22E4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.
Teilprojekt 6: Sekundärmetabolite von Hymenoscyphus fraxineus und seiner Antagonisten
Endophytische Pilze können durch das Ausscheiden von Sekundärmetaboliten Antagonisten von Hymenoscyphus fraxineus, dem Erreger des Eschentriebsterbens, sein. Solche Antagonisten sollen durch Dualkulturen mit H. fraxineus identifiziert und inhibitorische Sekundärmetabolite strukturell aufgeklärt werden. Um die Pathogenitätsmechanismen von H. fraxineus zu verstehen, sollen Sekundärmetabolite des Erregers strukturell und funktionell aufgeklärt werden.
Langfristig sollen antagonistische Endophyten in Eschen inokuliert werden, sodass ihre Metaboliten die Entwicklung des Eschentriebsterbens hemmen.
- Überprüfung der Pathogenität von H. fraxineus Isolaten aus Teilprojekt 2 und Teilprojekt 3 in axenisch kultivierten Eschensämlingen
- Analyse antagonistischer Endophyten mit hemmender Wirkung auf das Eschentriebsterben, die keine Symptome in axenisch kultivierten Eschensämlingen verursachen und in Teilprojekt 2 in nicht-axenische Eschen inokuliert wurden
- Aufklärung pilzlicher und bakterieller Sekundärmetabolite aus den Teilprojekten 3, 4 und 9
- Untersuchung der Dualinokulationen mit pilzlichen und bakteriellen Endophyten (Teilprojekt 9) hinsichtlich der Krankheitsprävention in planta

Hauptziel ist die Identifizierung der Sekundärmetabolite, auf denen die metabolischen Interaktionen zwischen Esche, H. fraxineus und den konkurrierenden endophytischen Pilzen beruhen. Daher werden zusätzlich zu den bereits vorhandenen ca. 250 endophytischen Pilzen aus der Esche (Stammsammlung TU-Braunschweig) weitere endophytische Pilze nach Oberflächensterilisation von Blättern, Zweigen und Wurzeln aus gesunden und kranken Eschen isoliert und identifiziert.
Die Endophyten werden in Dualkultur mit H. fraxineus hinsichtlich ihrer hemmenden Eigenschaften analysiert. Isolate mit antagonistischer Wirkung werden in axenische Eschensämlinge inokuliert. Drei Monate nach der Inokulation kann erkannt werden, ob der Endophyt die Sämlinge asymptomatisch besiedelt. Asymptomatisch besiedelnde Endophyten werden dann zusammen mit dem Erreger H. fraxineus in axenische Eschensämlinge inokuliert, um zu analysieren, inwieweit der
Endophyt die Krankheitssymptome des Eschentriebsterbens unterdrücken kann. Vielversprechende Kandidaten werden anschließend vom Teilprojekt 2 in ein- und drei-jährigen nicht-axenischen Eschen getestet.
Zur Strukturaufklärung inhibitorischer Sekundärmetabolite werden ausgewählte Isolate (Teilprojekt 4, Teilprojekt 5, Teilprojekt 6, Teilprojekt 9) unter verschiedenen Bedingungen kultiviert, Kulturextrakte hergestellt und Reinsubstanzen mittels chromatographischer Verfahren isoliert. Zur Identifikation neuer Metaboliten werden Kernresonanzspektroskopie und Massenspektrometrie eingesetzt. Isolate, Kulturextrakte und Reinsubstanzen werden jeweils hinsichtlich ihrer hemmenden Wirkung auf H. fraxineus und andere antibiotische Aktivitäten getestet. Die taxonomische Einordnung antagonistisch wirksamer Stämme und die Charakterisierung ihrer Sekundärstoffprofile erlaubt den Ausschluss von Mykotoxinproduzenten. Darüber hinaus werden Metabolite von H. fraxineus (auch von Teilprojekt 2 und Teilprojekt 3), die sich in einem Blattsegmenttest der Esche als Inhibitor erweisen, ebenfalls strukturell analysiert. Die gewonnenen Reinsubstanzen werden anderen Teilprojekten zur weiteren Analyse zur Verfügung gestellt.
- Das Eschentriebsterben wird von einem krankheitsauslösenden Pilz, Hymenoscyphus fraxineus, verursacht. Ziel des Projekts ist es diese Krankheit zu bekämpften. Hierzu sollen harmlose, pilzliche Endophyten verwendet werden, die in Pflanzen wachsen ohne Krankheiten zu verursachen und gleichzeitig Metabolite produzieren, die H. fraxineus hemmen. Aus Untersuchungen an anderen Pilz-Baum-Interaktionen ist bereits bekannt, dass die biologische Bekämpfung mit endophytischen Pilzen, die aktive Metaboliten gegen Krankheitserreger ausscheiden, zur Behandlung von Bäumen erfolgreich eingesetzt werden kann.
- Für die Entwicklung der biologischen Behandlungsmaßnahme werden endophytische Pilze isoliert und die chemischen Strukturen ihrer inhibitorisch wirkenden Metaboliten aufgeklärt. Anschließend werden Eschensämlinge im Labor mit diesen Endophyten infiziert. Die Kandidaten, die H. fraxineus-Infektionen erfolgreich abmildern oder verhindern, werden weiter in jungen Eschenbäumen getestet. Unter Umständen erweist sich eine Mischinokulation mit mehreren Pilzen oder mit Pilzen und Bakterien als die erfolgreichste Behandlung der Esche (Zusammenarbeit mit Teilprojekt 2 und Teilprojekt 9).
- Ein weiterer Ansatzpunkt, um das Eschentriebsterben zu bekämpfen, könnten auch die krankmachenden Faktoren (Virulenzfaktoren) des Pathogens H. fraxineus darstellen. Hierzu gehören Substanzen, die der Krankheitserreger produziert, um Konkurrenten auszuschalten, oder die den Baum direkt schädigen. Um die schädlichen Einflüsse dieser Virulenzfaktoren auszuschalten, werden auch die chemischen Strukturen dieser Metabolite aufgeklärt.
- Für eine erfolgreiche Bekämpfung des Eschentriebsterbens wird es notwendig sein, die Esche durch verschiedene Maßnahmen zu stärken und zu behandeln, wozu dieses Projekt einen wichtigen Beitrag zu leisten hoffen.

Ansprechpersonen
Prof. Dr. Michael Steinert, m.steinert@tu-bs.de
PD Dr. Barbara Schulz, b.schulz@tu-bs.de
Förderkennzeichen: 2219WK22F4
Weitere Informationen zum Projektpartner finden Sie hier.
Teilprojekt 7: Bekämpfung des Eschentriebsterbens mit Hilfe natürlich vorkommender hypovirulenter Viren
- Überprüfung des Potentials von Viren aus H. fraxineus und weiteren Pilzen auf eine Reduktion der Infektiosität (Hypovirulenz) für einen Einsatz zu einer ökologischen Bekämpfungsstrategie
- Eigene Aufsammlung von Makromyceten (Schwerpunkt: Basidiomyceten) und Nachweis von Virusinfektionen; Anlage von Reinkulturen von Basidiomyceten mit nachgewiesener Virusinfektion
- Nachweis von Viren aus Pilzreinkulturen (Schwerpunkt: Ascomyceten) aus bestehenden Sammlungen anderer Teilprojekte
- Charakterisierung neu gefundener, bisher nicht bekannter Viren
- Isolierung von Viruspartikeln
- Etablierung von Transformation und Transfektion (Einbringung von freier DNA in eine Zelle) in H. fraxineus
- Transfektion von verschiedenen Viren in H. fraxineus und Nachweis der Infektion
- Untersuchung von Wirtsspezifitäten neuer Pilz-Virus Kombinationen
- Evaluierung der Hypovirulenz durch phänotypische Analyse infizierter Stämme von H. fraxineus
- Virulenztestung transfizierter Stämme von H. fraxineus an Eschensämlingen durch Teilprojekt 2
- Bereitstellung hypovirulenter Stämme zur Ergänzung der Untersuchungen zu Infektionsmechanismen und zum Design von siRNAs durch Teilprojekt 8
- Untersuchung der Wirt-Pathogen-Interaktion infizierter Stämme von H. fraxineus mit Eschen durch Teilprojekt 5
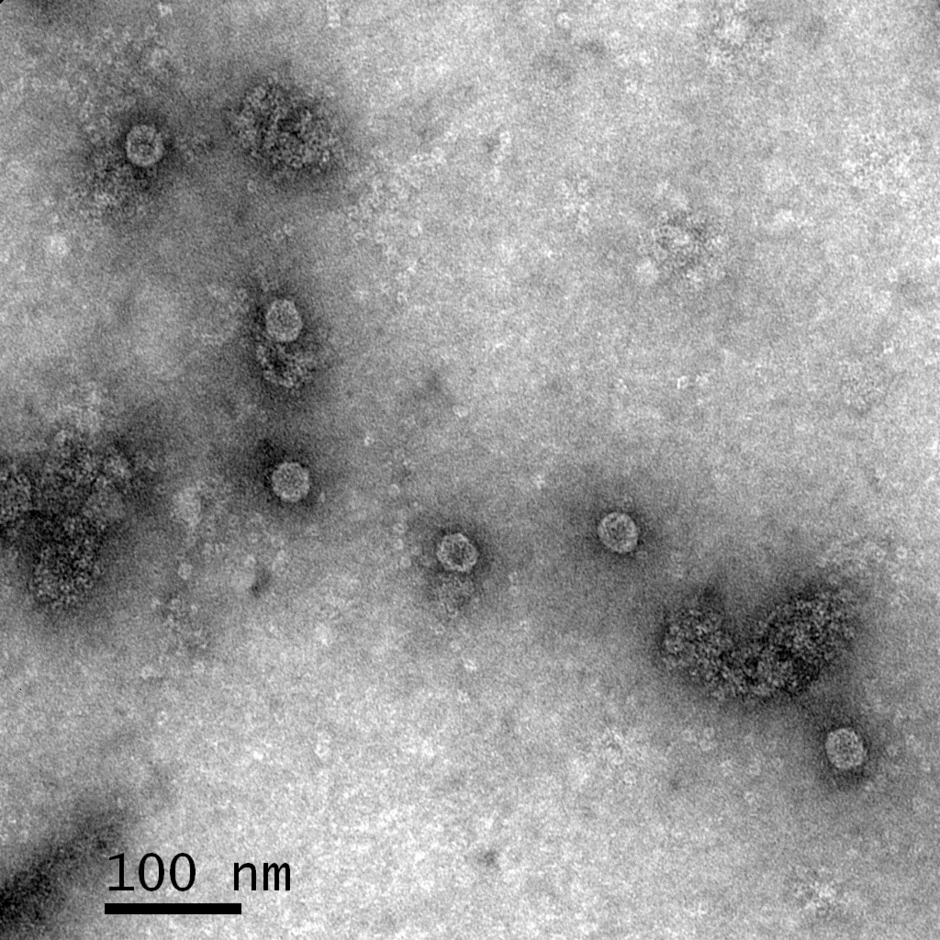
Eigene Aufsammlungen von Makromyceten werden auf Virusbefall untersucht. Bei erfolgtem Virusnachweis wird zur Vermehrung eine Reinkultur angelegt. Parallel dazu werden diverse Pilzisolate, welche von befallenen Eschen isoliert wurden (Teilprojekt 1), ebenfalls auf eine Virusinfektion untersucht.
Bei einem positiven Befund werden Viruspartikel aus dem Myzel der Reinkultur isoliert und das Virus wird charakterisiert. Die Charakterisierung umfasst zum einen die Bestimmung der Sequenz und zum anderen die phänotypische Auswirkung der Infektion auf das Wachstum der Kultur. Dazu wird das Wachstum entweder mit Virus-freien Isolaten derselben Art verglichen oder die Viren werden aus den infizierten Kulturen eliminiert. Vorgehensweisen zur Isolierung von Viruspartikeln zur späteren Transfektion werden entwickelt. Hierzu müssen sowohl Ausbeute als auch die Reinheit optimiert werden. Für den Nachweis einer Infektion werden diagnostische Werkzeuge ausgearbeitet.
Parallel zu der Charakterisierung und Isolierung von Viren aus verschiedenen Kulturen wird eine Vorgehensweise zur Transformation und Transfektion von H. fraxineus auf der Grundlage von Protoplasten (Zellwand-lose Zellen) entwickelt. Eine solche ist für den Erreger oder einen seiner Verwandten bisher nicht beschrieben worden. Die Protoplasten von H. fraxineus werden schließlich mit den neu charakterisierten Viren infiziert. Die erfolgreiche Etablierung der Infektion wird mit den entwickelten diagnostischen Werkzeugen nachgewiesen und die Kulturen werden auf phänotypische Veränderungen untersucht. Ausgewählte H. fraxineus-Virus-Kombinationen, die auf eine mögliche veränderte Virulenz deuten, werden zur Testung auf Eschensämlingen durch Teilprojekt 2 bereitgestellt. Die Virus-infizierten Pilz-Stämme werden von Teilprojekt 8 zum Design von siRNAs genutzt und können zur Untersuchung der Wirt-Pathogen-Interaktion in Teilprojekt 5 beitragen.
Fungizide werden in der Landwirtschaft und im Gartenbau erfolgreich eingesetzt. Im Gegensatz zu diesen Monokulturen besteht das Ökosystem Wald aus einem empfindlichen Beziehungsgeflecht verschiedenster Organismen. Da Fungizide nicht selektiv auf den Erreger H. fraxineus wirken, sondern eine Vielzahl verschiedenster Pilze treffen, ist eine Bekämpfung mit Fungiziden undenkbar. Es wird also eine Alternative gesucht, die eine selektive Bekämpfung des Erregers ermöglicht. Der Einsatz von Viren könnte diesbezüglich erfolgreich sein, denn Viren können - in seltenen Fällen - die Infektiosität des pilzlichen Erregers herabsetzen. Dieses Phänomen ist als Hypovirulenz bekannt. Für die Bekämpfung des Kastanienrindenkrebses (Cryphonectria parasitica) wird bereits ein Virus (Cryphonectria parasitica Hypovirus 1) für die Bekämpfung des Pilzes in Europa erfolgreich eingesetzt. Der Vorteil einer solchen Bekämpfungsstrategie ist, dass sich die Viren selbständig vermehren und ausbreiten, aber auf natürliche Weise nicht weitere Pilzarten infizieren können und damit auf die jeweilige Pilzart begrenzt bleiben. Das Ökosystem als Ganzes wird also nicht beeinflusst. Eine künstliche Infektion über Artengrenzen hinweg ist im Labor dagegen für einige Pilz-Virus Kombinationen möglich.
Viren, welche die Infektiosität des H. fraxineus herabsetzen, sind trotz intensiver Suche bisher nicht beschrieben worden. Deswegen müssen Viren gefunden werden, die über künstliche Infektion in den Erreger H. fraxineus eingebracht werden und hier eine Reduzierung der Infektiosität bewirken. Für H. fraxineus ist bisher weder eine Vorgehensweise zur Transfektion von Viren noch für eine Transformation von DNA beschrieben worden. Beide, Transfektion und Transformation, werden im Rahmen des Projektes entwickelt.
Anhand des Phänotyps verschiedener Virus-infizierter H. fraxineus-Isolate wird das Potential zur Reduzierung der Infektiosität (Hypovirulenz) abgeschätzt. Erfolgversprechende Infektionen werden für den Biotest in Teilprojekt 2 vorgeschlagen. Transfektionen und Transformationen können außerdem bei der Analyse von Wirt-Pathogen-Beziehung und der Entwicklung von Zielsequenzen helfen.

Fachbereich Biologie - Institut für Pflanzenwissenschaften und Mikrobiologie, Molekulare Phytopathologie
Projektleiterin
PD Dr. Cornelia Heinze, cornelia.heinze@uni-hamburg.de
Wissenschaftlicher Mitarbeiter
Tobias Lutz, tobias.lutz@uni-hamburg.de
Förderkennzeichen: 2219WK22G4
Weitere Informationen finden Sie hier.
Teilprojekt 8: Innovative RNA Interferenz (RNAi)-vermittelte Bekämpfung von Hymenoscyphus fraxineus, dem Erreger des Eschentriebsterbens
- Es wird untersucht, ob RNA-Interferenz als nicht-chemische Bekämpfungsmethode gegen Hymenoscyphus fraxineus eingesetzt werden kann
- Das Ziel ist, eine Infektion von H. fraxineus in befallenen Eschensämlingen zu stoppen
- Im Fokus stehen Untersuchungen zur Anwendbarkeit und Optimierung der Methode
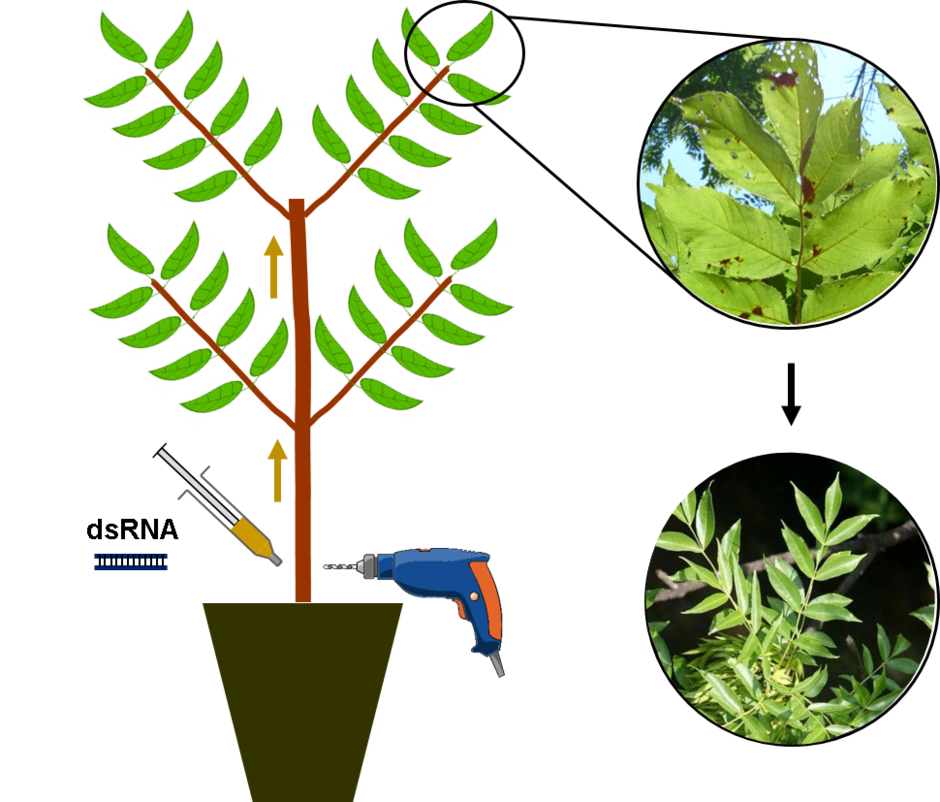
Schema: L. Hohenwarter; Foto oben: FVA; Foto unten: Robert Vidéki, Doronicum Kft., Bugwood.org (Nr. 5395833).
Zu Beginn der Untersuchung wird überprüft, ob die essentiellen Enzyme des RNAi-Mechanismus in H. fraxineus vorhanden sind. Als nächstes werden mit molekularbiologischen und anschließenden bioinformatischen Methoden die Expressionsstärken für den Pilz lebensnotwendiger Gene beschrieben (Transkriptom-Analyse), um geeignete Zielgene identifizieren zu können. Diese Gene sollen anschließend mit Hilfe der RNAi ausgeschaltet und somit der Pilz im Wirt letal geschädigt werden.
Für die Zielgene werden sequenz-homologe Doppelstrang-RNAs (dsRNA) hergestellt und die Wirksamkeit dieser dsRNAs als H. fraxineus-Wachstumshemmer wird mit in-vitro Kulturen (Petrischale) des Pilzes getestet. Parallel wird die Applikationsmethode "Stamminjektion" an Eschensämlingen getestet. In ein in den Stamm gebohrtes Loch wird die dsRNA-Lösung injiziert. Mit dem Nachweis der dsRNA in apikalen Blättern wird der RNA-Transport über die Leitbahnen der Esche verifiziert.
Es folgen Wirksamkeitsstudien der aussichtsreichsten dsRNA-Kandidaten mit infizierten Eschensämlingen. Diese Studien werden zuerst im Gewächshaus und dann unter naturnahen Bedingungen durchgeführt. Dabei wird die dsRNA durch Stammapplikation oder Besprühen der Blätter eingebracht. Zusätzlich werden verschiedene Herstellungsverfahren für dsRNA getestet, bezüglich ihrer Effizienz evaluiert und so möglicherweise ein optimiertes Verfahren neu entwickelt.
- Die Applikation der dsRNA hat viel Potenzial langfristig und nachhaltig zum Erhalt der Esche beizutragen, da es ein therapeutischer, kurzfristig wirksamer Ansatz ist und es zurzeit keine geeignete Methode zur direkten Bekämpfung des Erregers des Eschentriebsterbens gibt.
- Die Ergebnisse der Untersuchungen können auch auf andere Wirt-Pathogen-Systeme übertragen werden. Dafür wäre nur die Anpassung der dsRNA-Sequenz an die neuen Zielgene der Pathogene notwendig.
- Die Methode lässt sich zudem auf einen großen Maßstab skalieren, z. B. für den Einsatz in Baumschulen mit mehreren Hundert Sämlingen. Dafür ist die ökonomisch effiziente Herstellungvon dsRNA notwendig. Zudem bietet sich eine Nutzung von automatisierten Applikationsrobotern an.
- Der Transport von stammapplizierter dsRNA zu den Blättern wurde schon in anderen Bäumen und Pflanzen nachgewiesen und es ist zu erwarten, dass Eschen hier keine Ausnahme machen. Offen ist derzeit noch, ob die dsRNA effektiv von H. fraxineus aufgenommen wird und es zum Stilllegen der Zielgene führt.

Ansprechperson
Prof. Dr. Gabi Krczal
Förderkennzeichen: 2219WK22H4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.
Teilprojekt 9: Optimierung der Mikrobiota vitaler Eschen-Genotypen zur Erhöhung der Widerstandsfähigkeit gegenüber Hymenoscyphus fraxineus
- Untersuchung mikrobieller Antagonisten mit dem Ziel der biologischen Kontrolle des Erregers des Eschentriebsterbens durch direkte Hemmung oder durch Konkurrenz
- Prüfung der Wirkung bakterieller und pilzlicher Isolate auf die Toleranz von Eschensämlingen gegenüber dem Erreger H. fraxineus unter Freilandbedingungen
- Bei der Prüfung werden selektierte widerstandsfähige Eschen-Genotypen verwendet, um synergistische Effekte in der Wirkung gegen den Erreger zu erreichen – Zusammenarbeit mit Projekten des Forschungsverbunds FraxGen
- Evaluierung der erfolgreichen und langfristigen Etablierung der Inokulationsstämme und damit der anhaltenden Wirkung der Antagonisten
In einem laufenden Projekt konnten erfolgsversprechende Bakterien- und Pilz-Isolate identifiziert werden, die über Kolonisierungsresistenz oder direkte antagonistische Aktivität wachstumshemmende Effekte gegenüber dem Erreger H. fraxineus aufweisen. Unter Nutzung dieses Materials soll die Zusammensetzung der Mikroorganismen-Gemeinschaft (Mikrobiota), die die Esche besiedeln, im Freiland so beeinflusst werden, dass die Widerstandsfähigkeit gegenüber dem Erreger erhöht wird. Dazu werden die Eschen mit den Bakterien- und Pilzisolaten beimpft (inokuliert). Durch die Verwendung selektierter widerstandsfähiger Eschen-Genotypen (Zusammenarbeit mit dem Forschungsverbund FraxGen) soll die Wirkung über synergistische Effekte optimiert werden.
Um zu überprüfen, ob sich die inokulierten Bakterien- und Pilzisolate erfolgreich ansiedeln konnten, erfolgt ein quantitativer Nachweis mit molekularbiologischen Methoden. Hierfür werden zunächst auf der Basis ihrer Genomsequenzen spezifische real-time PCR-Systeme entwickelt und auf ihre Spezifität, Sensitivität und Effizienz hin untersucht.
Im Frühjahr unmittelbar nach Blattaustrieb werden Blätter und Triebe der Eschenjungpflanzen mit Einzelisolaten oder Konsortien (Isolatemischungen) inokuliert. Im Herbst erfolgt das Auspflanzen der Eschen auf die Freifläche. Nach der Inokulation wird die erfolgreiche und langfristige Etablierung der Inokulationsstämme über real-time PCR geprüft und auch ihre Wirkung gegenüber dem Pathogen in Abhängigkeit vom Pflanzengenotyp evaluiert. Zum Nachweis der antagonistischen Wirkung im Freilandtest erfolgt die Analyse der Performance der inokulierten Eschen und der Widerstandsfähigkeit gegenüber dem Erreger H. fraxineus. Hierfür wird sowohl eine Bonitur der Krankheitssymptome als auch der quantitative Nachweis des Erregers über real-time PCR vorgenommen. Abschließend erfolgen eine Bewertung der geprüften Isolate und Konsortien nach ihren Wirkungen im Freiland und die Auswahl der effektivsten Stämme. In der letzten Projektphase werden die besten Inokulationsstämme exemplarisch in Samenplantagen zur Etablierung von Eschengenotypen mit hoher Widerstandsfähigkeit gegenüber H. fraxineus eingesetzt.
In den letzten Jahrzehnten wurden zur Ertragssteigerung in Land- und Forstwirtschaft regelmäßig Fungizide eingesetzt, um Pilzkrankheiten zurückzudrängen. Ergebnis war häufig die Entwicklung von Resistenzen der Erreger gegen die eingesetzten Mittel. In der Forstwirtschaft ist der Einsatz von Fungiziden außerdem aus ökologischen und praktischen Gründen oft nicht angebracht. Einen komplett anderen Weg verfolgt die Forschung zur biologischen Kontrolle, die sich die antagonistischen Wechsel¬wirkungen zwischen den Mikroorganismen zu Nutze macht. Es existieren bereits umfangreiche Studien zu den antagonistischen Wirkmechanismen und eine langjährige kommerzielle Nutzung mikrobieller Präparate bei der Kontrolle von Pilzkrankheiten.
Im Mittelpunkt steht die Entwicklung eines biologischen Kontrollsystems für den Erreger des Eschentriebsterbens auf Basis von mikrobiellen Antagonisten. Die zeitliche Bestimmung der Persistenz der bakteriellen und pilzlichen Inokulationsstämme sowie des Erregers ermöglicht weitere Einblicke in die Konkurrenz innerhalb der Mikrobiota und die Interaktion mit der Pflanze. Zusätzlich kann so die Stabilität des biologischen Kontrollsystems eingeschätzt und überprüft werden.
Die Ergebnisse des Projekts erweitern am Beispiel des Eschentriebsterbens den Kenntnisstand zur Rolle der pflanzlichen Mikrobiota bzw. einzelner Antagonisten bei der Ausprägung von Resistenzen gegenüber biotischen Schaderregern und tragen zum Erkenntnisgewinn in der Interaktionsbiologie (Wechselwirkungen Pflanze-Mikroorganismen) bei.

Ansprechperson
Dr. Andreas Ulrich, aulrich@zalf.de
Förderkennzeichen: 2219WK22I4
Weitere Informationen zu diesem Teilprojekt finden Sie hier.

